一、结构决定性质
“结构决定性质”,有些物质虽然都是由同样的元素构成,但是内部结构不同,性质就大相径庭。通俗点说,同样一群人,排不同的阵势去打仗,发挥的效果是不一样的。
碳元素是个大家庭,有众多同素异构体。虽然都由碳原子构成,但由于拥有各种不同的分子晶体结构,所以它们的物理性质截然不同,差别极大。比如,以最普通的成员金刚石及石墨为例,它们的许多物理性质分别位于两个极端:石墨性软,钻石却是最硬的矿石。石墨是良导体,钻石是绝缘体。石墨乌黑不透明,钻石晶莹剔透闪亮光。石墨极为普通随处可见,钻石却是价值昂贵的珠宝。
碳的同素异构体中,石墨是碳原子以SP2杂化轨道相互成键的,SP2杂化轨道的成键特征,决定了石墨是一种平面六方的层状结构。由于层间靠较弱的范德华力结合,所以层与层之间很容易滑移。这种性质使石墨可用于润滑剂和铅笔芯之中。此外,原子层之间较弱的范德华键也让一些电子可以沿层面自由流动,使石墨成为良好的导电体。

金刚石是碳原子以SP3杂化轨道形成的正四面体结构,是由具有饱和性和方向性的共价键结合起来的晶体。硬度、熔点、耐磨性都极高,而且不导电。

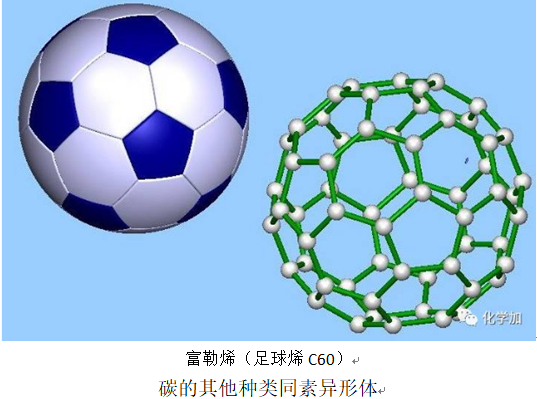
碳的其他同素异形体结构,还有石墨烯、碳纳米管、富勒烯(C60)等,基本上都以类似的平面正六边形结构为主,有时也混杂了一些五边形和七边形。这些不同结构各有特点,如果忽略很小的纳米尺度,从几何维数来分类,可以将碳纳米管看成是1维结构,石墨烯是2维结构,富勒烯则可以算是点状的0维结构,最典型的富勒烯是拥有60个碳原子的巴克球C60,其结构与一个现代足球类似。

二、碳家族来了新成员
在富勒烯(C60)的基础上,科学家们还研发了两种不同形态的金刚石:非晶态金刚石和次晶态金刚石,这两种结构既保留了金刚石的硬度,又改善了原始金刚石的脆性,有着更强大的力学性质和热稳定性。该研究成果曾在线发表于权威学术期刊《自然》杂志上。
次晶态金刚石的合成除了填补理论上的空白,更具备广泛的应用价值。它除了具有和普通晶体金刚石相当的力学性能以外,还有非常独特的可调节的光学性能。“这意味着次晶态金刚石可能会是一个极端条件下非常良好的窗口材料。”由于次晶态金刚石具有非常宽的荧光峰和较高的热稳定性,预期未来将在包括生物医学等在内的多个领域产生更加广泛的应用。
另一个新成员非晶态金刚石结构中,SP3碳的比例可以达到97.1%。这种新型材料的硬度与抵抗形变的能力与天然金刚石相当,是已有的非晶质材料中硬度、热导率最高的。
这两项研究不仅为庞大的碳家族添加了两个全新的成员,还为更多应用提供了可能性。相比于常规的晶体金刚石,次晶态与非晶态的金刚石有着更突出的力学性质。此外,它们的热稳定性也更优越,因此在精细加工和一些极端环境中或将拥有广阔的应用前景。

碳材料几乎包括了地球上所有物质所具有的的性质。在科学家们的探索中,还有很多新型碳材料在不断发现中。可以说没有哪种元素能像碳这样,作为单一元素可形成如此之多的结构和性质完全不同的物质。这也正是碳元素的魅力所在!


 手机资讯
手机资讯 官方微信
官方微信










 豫公网安备41019702003646号
豫公网安备41019702003646号