亨廷顿病(HD)是一种遗传性神经退行性疾病,临床表现为运动异常、精神症状和认知能力下降。机理研究显示,HD是由4号染色体上的一个突变引起的,当CAG重复序列超过35-40时,有毒的亨廷顿蛋白聚集。自由基的产生在HD的进展中起着关键作用,尽管目前仍不确定它们是其他病理事件的病因还是结果。
目前,用于测量自由基生成的方法包括:间接方法和分子影像学技术。间接方法测量自由基或特定分子对自由基产生的反应产物。分子影像学技术包括用显微镜工具进行光学标记,或用磁共振技术进行磁共振标记,如磁共振成像(MRI)或电子自旋共振(ESR)。然而,这些方法通常测量反应产物的累积历史,而非当前状态。由于反应分子在这段时间内可以自由扩散,因此空间分辨率有限。此外,这些分子可以与自由基发生反应,从而影响自由基的浓度,而且它们往往具有一定程度的固有毒性。许多探针表现出与其他活性分子或特定酶的交叉反应性。
基于金刚石NV(氮空位)中心的量子传感提供了一个有吸引力的替代方案。这些NV中心释放出前所未有的稳定红色荧光,其强度会根据自旋状态而变化。因此,人们可以使用这种荧光来测量磁场或磁噪声。最近,这种技术已被用于测量活细胞中自由基的生成。如:测量癌细胞、细菌、免疫细胞、酵母细胞的应激反应,或作为细胞对病毒的反应。在本次分享的文章“In Vivo Nanodiamond Quantum Sensing of Free Radicals in Caenorhabditis elegans Models”中,作者同样利用量子传感揭示线虫细胞中polyQ位置的应激反应(图1)。在HD模型中,研究人员选取了AM141 Q40::YFP、OW450 Q0::YFP(阴性对照)、GA480(缺乏双超氧化物歧化酶基因sod-2和sod-3,作为氧化应激的阳性对照)线虫株来评估氧化应激的水平。
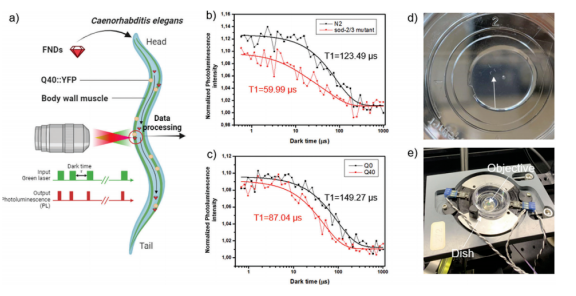
图1 a.基于金刚石的量子传感示意图
b-c. 不同线虫株在量子传感实验中呈现不同的荧光强度 d-e.用于量子传感实验的装置图
FNDs的吸收和分布
为防止FNDs(fluorescent nanodiamonds)的积累并促进线虫对颗粒的吸收,研究人员将牛血清白蛋白(BSA)包裹在FNDs上,并将FND/BSA通过口服给药饲喂给线虫,观察adult Day1的N2和GA480虫株,在其消化系统的管腔内发现清晰可见FNDs的荧光。而且在邻近细胞中也发现了一些FNDs,说明FND/BSA可以穿过肠道细胞并扩散到其他部位(图2)。

图2 FND/BSA的吸收分布情况
进一步采用等剂量孵育方案处理OW450 Q0::YFP和AM141 Q40::YFP线虫,发现FND/BSA在体内呈现差异化分布,在消化腔内之外,一些颗粒扩散到体壁肌区,与扩散的YFP产生共定位(图3b)或停留在polyQ聚集物附近(图3c)。

图3 FND/BSA在HD模型线虫中的分布情况
采用T1弛豫法检测自由基
T1弛豫测量法依赖于感知FND周围的磁噪声,实现了活体线虫体壁肌肉组织中PolyQ蛋白聚集体附近自由基的原位检测。这里值得一提的是,实验过程中线虫本体与纳米金刚石均存在0-1μm的位移。如果纳米金刚石与polyQ聚集物在相同的位置(例如,它们在同一个囊泡中,或者随线虫整体运动),那么二者的相对位置保持恒定。自由基也可以在细胞中扩散,但它们的扩散范围受到其寿命的限制,仅在数十纳米范围内才能被纳米金刚石有效检测。在一次测量中,研究人员选择了一个光子数约为107的纳米金刚石。线虫自发荧光光子数低于106,因此很容易将自发荧光与 FND 区分开来。首先选择一个位于线虫体内期望位置的FND(图4a),随后在激光脉冲过程中进行动态追踪(图4a1,a2),并进行双指数衰减分析。实验中采用650nm滤波器去除YFP干扰信号。关键参数T1值由双指数曲线的衰减速度来量化,反映了周围环境中的磁噪声。T1值越低,表示自由基浓度越高。
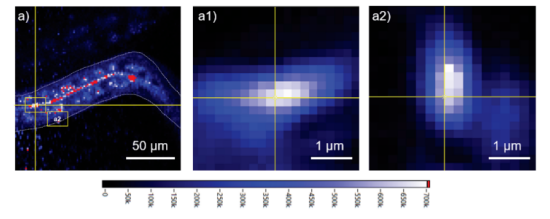
图4a Q40线虫中FND/BSA的荧光图像。
白色的虚线是身体的边界。底部显示的强度条表示光子数/s
如图1b所示,在体壁肌肉附近的单次FND测量中,sod-2/3突变线虫的T1值低于N2,验证了该技术在活体模型中的可靠性,并揭示T1降低与自由基浓度升高的剂量效应关系。研究进一步对OW450、AM141株系进行测量,发现AM141体内的FND产生更快的衰变。从单次FND测量中可以观察到Q0和Q40之间的差异,表明T1弛豫测量法具有高灵敏度。
在扩大样本量的验证实验中,研究团队对N2和sod突变线虫进行组间比较,每组选择30多只线虫进行重复测量。结果显示两株线虫肌肉、肠道的T1值均具有显著性差异(p≤0.0001),提示sod突变体全身存在应激胁迫。然而,在N2和Q0线虫之间的比较显示,两者仅在肌肉上有显著差异(图4b),而在肠道中没有显著差异(图4c)。由于Q0::YFP主要在身体肌肉中表达,这一结果证明外源YFP蛋白的表达本身即可诱发局部氧化应激。
Q40与Q0线虫身体肌肉相比(图4b),Q40的T1值出现了显著的下降(p≤0.01),提示Q40中自由基水平的升高。另外,实验发现Q0的数据比Q40的数据分布更大,这种差异可能归因于T1的非线性浓度依赖性,在较低的自由基浓度下T1的变化更为敏感。在肠道中(图4c),在Q0和Q40线虫之间也观察到显著的差异,这可能是由于Q40线虫中各种应激反应(包括skn-1介导的应激反应、daf-16介导的氧化应激反应和缺氧反应)被激活,从而诱发肠道应激胁迫。
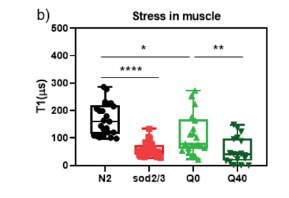
图4b-c 不同线虫株的肌肉和肠道T1值差异性比较
T1校准曲线显示,Q0和Q40线虫之间不同组织的自由基浓度变化是不同的。在肠道中,磁信号浓度从Q0的≈0.3nM增加到Q40的≈10.4nM。然而,在身体肌肉中,增加的幅度要大得多,从Q0的2.9nM到Q40的9100nM,表明肌肉中PolyQ产生的自由基明显多于肠道的自由基。针对线虫不同部位进行T1测量,发现:在AM141 Q40::YFP成虫中,Q40主要积累在体壁肌细胞中,与肠道相比,其自由基水平显著增加。同样地,OW450 Q0::YFP的体壁肌肉自由基水平明显高于肠道,进一步说明YFP的表达直接促进了自由基的生成(图4d-e)。
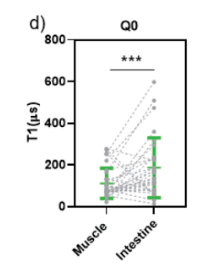
图4d-e 线虫不同组织间的T1差异性比较
小编总结
本研究证明了使用T1弛豫测量法检测生物体中自由基水平的可行性,特别是在线虫HD模型中。研究人员观察到,在表达polyQ线虫中,T1值显著降低,表明氧化应激水平升高。此外,通过在不同的身体部位进行T1测量,能够区分polyQ聚集物和外源性YFP蛋白对自由基生成的贡献。这些发现强调了T1弛豫测量法作为研究疾病模型中氧化应激动力学的敏感工具的潜力。此外,该研究强调了量子传感技术的实用性,如T1弛豫测量法,在体内纳米水平上探索生物过程,为进一步了解神经退行性疾病的发病机制和靶向治疗策略的发展提供了新的道路。
参考文献:Fan S, Zhang Y, Ainslie AP, et al. In Vivo Nanodiamond Quantum Sensing of Free Radicals in Caenorhabditis elegans Models. Adv Sci (Weinh). DOI:10.1002/advs.202412300


 手机资讯
手机资讯 官方微信
官方微信










 豫公网安备41019702003646号
豫公网安备41019702003646号